LOS GASES
El gas es un estado de agregación de la materia. Estos están formados por átomos o moléculas pequeñas separadas una de otras que se mueven de manera continua y que se chocan entre si o con las paredes del recipiente que los contiene. Estos se expanden y se comprimen debido a que su volumen es variable; carecen de forma definida, debido a que la fuerza entre los átomos y las moléculas no tienen efectos apreciables, están muy separadas y se mueven de manera rápida. Tienen la característica de efusión, es decir: “pueden atravesar pequeños orificios o poros”.
Propiedades
-Son intangibles,
imposibles de tocar, carecen de color y sabor.
-No tienen una forma definida, esta debe del envase que
las contiene
-Carecen prácticamente de fuerzas de unión entre sus partículas.
-La unidad del SI para medir la presión es el pascal Pa y
el aparato que se utilizar es el manómetro.
-Los gases presentan fluidez, característica que permite
a sus partículas moverse de manera constante y al azar.
-La elasticidad de los gases les permite recuperar sus
dimensiones originales cuando cese la comprensión.
-La presión de un gas es consecuencia de los choques de
las moléculas de este.
-Cada una de las partículas posee una energía cinética.
-Las partículas que conforman un gas están en constante
movimiento caótico, los choques no suponen una pérdida de energía, pero si
pueden transmitir la energía de una molécula a otra.
-Los átomos o moléculas de los gases están muy separadas
y se mueven con gran rapidez y en dirección a al zar. Por ejemplo: la velocidad
media de una molécula de hidrogeno a 25 °C es de 1768 m/s, casi 6400 km/hora.
Ejemplos:
-En algunos alimentos se manifiesta de forma natural
algunos gases, como es el caso de “El metil marcaptano” que es un gas incoloro
e inflamable con un olor característico que se manifiesta en la cebolla.
-El biogás
-El gas licuado de petróleo
Nota: En los gases se tienen en
cuenta las variaciones que ocurren en la temperatura, el volumen y la presión.
Variables
La temperatura: Es el promedio de la energía cinética de todas las moléculas
que conforman un determinado material, esta se mide mediante las escalas de “Celsius
°C, Kelvin k, Fahrenheit °F”, pero según el SI afirma que la unidad internacional
para medir la temperatura es el Kelvin, cuando la molécula tiene una energía cinética
nula, su valor es el llamado cero absoluto; en un gas, la temperatura se
relaciona con la medida de la velocidad y por esto se dice que: “a mayor
temperatura mayor velocidad media”
La presión: Es la fuerza ejercida sobre un área específica, las moléculas de un gas están en continuo movimiento y tienen diferentes direcciones, esto ocasión que haya distintos choques, los cuales generan una fuerza denominada “Presión”, esta se mide en diferentes unidades, pero la principal esto delegado por el SI es el pascal Pa y para ello se utiliza un manómetro, la presión atmosférica normal constituye una unidad: La atmosfera atm.
El Volumen: Es el espacio que ocupa una sustancia, esta es dada en 3 dimensión
"al cubo". Los gases no tienen un volumen constante, el cual depende
del recipiente que los contengan. La unidad del volumen es el cm3 que equivale
a 1 ml. Se afirma que el volumen que presentan estas sustancias es variable: al
comprimirlas se reduce y al expandirlas aumenta.
Leyes
de los Gases...
Ley del gas ideal
Es un gas teórico compuesto por partículas que se mueven
al azar y que no interactúan entre ellas, responde a la teoría cinética y a las
leyes de los gases, nació cuando se suponía que su comportamiento era ideal
respecto a la temperatura y a la presión ambiental.
*Temperaturas altas +
Presiones bajas = Es
un gas ideal
*Temperaturas bajas +
Presiones altas = No es un gas ideal
+ Su formula
es:
PV
= nRT
-P = Presión (atm)
-V = Volumen (L)
-T = Temperatura (K)
-n = Mol (mol)
-R = Constante universal de
los gases
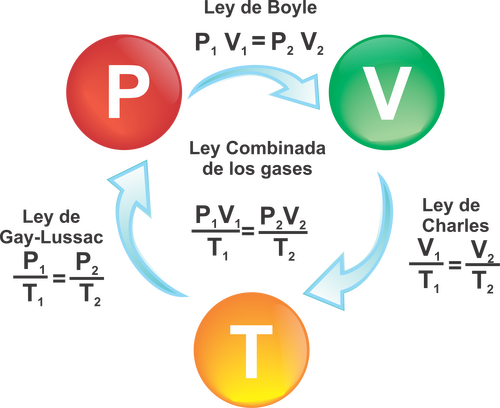
La ley de Boyle y Mariotte
Esta ley fue
estudiada por Robert Boyle y Edme Mariotte, ellos descubrieron la relación numérica
entre la presión y el volumen, donde lo concluyeron debido a un experimento donde
observaron la reducción del volumen sufría de cierta cantidad cantidad de gas cuando
se aumentaba la presión. Cuando se comprime un gas, se puede concluir que si
aumenta la presión disminuye el volumen y viceversa. Por esto se afirma que un
gas es inversamente proporcional a la presión cuando la temperatura es
constante.
La ley de Charles
El científico francés jaques Charles encontró que la relación
entre el volumen y temperatura de un sistema es indirectamente proporcional, se
dice que cuando se aumenta la energía cinética de los átomos o moléculas, por
esto se dice que existiría un mayor y mas fuerte numero de choques entre las partículas
y las paredes del recipiente. En los gases al aumentar la temperatura, su
volumen también aumenta si se mantiene una presión constante. Debido a que se
aumenta la temperatura se aumenta la energía cinética de los átomos o moléculas.
*Ejemplo: Cuando se infla globos al
aire libre en un día caluroso, en
poco tiempo se estallan.
La ley de Gay-Lussac
El francés Joseph Gay-Lussac, donde el relaciono la presión
y la temperatura de un gas, a volumen constante; cuando se aumenta la
temperatura a un gas, su volumen aumenta, pero si la idea es mantenerlo constante,
será necesario aumentar la presión.
La ley combinada de los gases
No mantiene ninguna variable constante, se utiliza cuando
se involucra todas las variables y se despeja una variable según lo que se
pregunte.
La ley de Avogadro
Afirma: A temperatura constante y presión constante, el
volumen de un gas confinado es directamente proporcional al numero de moles de
un gas.
*Ejemplo: Cuando se infla un globo
ingresan un numero de moléculas que ocupan un volumen; entre mas se sople, mayor
volumen tendrá el globo.
Ley de Dalton
Si se mezclan gases en un recipiente de un litro, la presión
ejercida dentro de él es igual a la suma de las presiones parciales, es decir,
a la presión que ejerce la masa de cada gas como si estuviera solo en el recipiente
y ocupara todo el volumen, por esto se dice que: “lo volúmenes no son aditivos.
Ley de Graham
Afirma que a iguales condiciones de presión y temperatura
las velocidades de difusión y efusión de los gases son inversamente proporcionales
a la raíz cuadrada de la masa molecular de los gases.